Pharmaceutical Stability Test Chambers
药品稳定试验箱



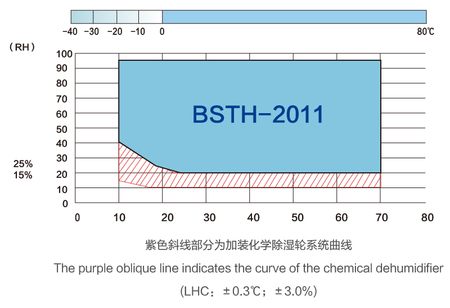
规格参数Specification parameter

药品安定性试验基准Benchmark for drug stability test
说明:
为确保药品质量,需执行安定性实验以推定其有效时间以及储存状态,安定性实验主要研究药品质量受到环境因素如温度、湿度及光线等影响是否随时间
变化以及关连行,研究出药品降解曲线,确保药品使用时的有效性及安全性。
药品之储存条件:
长期试验:25℃±2℃/60%±5%RH或30℃±2℃/65%±5%RH情况下进行试验
加速试验:40℃±2℃/75%±5%RH
中间试验:30℃±2℃/65%±5%RH
若长期试验之条件已设定为30℃±2℃/65%±5%RH时,则无中间试验,若长期储存条件在25℃±2℃/60%±5%RH情况下进行,
在加速试验若有显著变化12产生时,应追加中间试验。且应对照“显著变化”的标准加以评估。
玻璃安瓿等密封之不透性客器,可面除湿条件。除非另做认定,否则于中间试验,仍应依安定性试验计划书,执行所有检验项目。
加速试验资料须要六个月,安定性试验之中间试验及长期试验,对端涵盖时间为十二个月。
储存于冰箱:
长期试验:5℃±3℃;加速试验:5℃±2℃/60%±5%RH
储存于冷冻库:
长期试验-20℃±5℃;加速试验5℃±3℃;含水或溶剂等可能发生溶剂流失的之制剂,
若包装在半透性容器时,安定性评估应于低的相对湿度下,进行长期试验或中间试验12个月。
加速试验6个月,以证明置于半透性容器之药品,能耐受相对湿度的环境。
长期试验:25℃±2℃/40%±5%RH或30℃±2℃/35%±5%RH情况下执行长期试验;
加速试验:40℃±2℃/75%±5%RH;中间试验:30℃±2℃/65%±5%RH
若长期试验的条件为30℃±2℃/35%±5%RH时,则无中间试验。
定温40℃相对水分流失率之计算如下表:
替代相对湿度(A)对照相对湿度(R)水分流失速率比([1-R]/[1-A])
60%RH 25%RH 1.9;60%RH 40%RH 1.5;65%RH 35%RH 1.9;75%RH 25%RH 3.0
说明:置于半透性客器之含水药品,25%RH下其水分流失率是75%RH的三倍。

 中国
中国 English
English